seit 2025 – Wissenschaftlicher Mitarbeiter (unbefristet), Uniklinikum Düsseldorf
2022 – Doktor der Neurowissenschaften (PhD), Lissabon
2009 – Masterabschluss Physik (Diplom), München
2007 – Masterabschluss Biowissenschaften (MSc), Paris
Grundlagenforschung
Was natürliche Nervensysteme leisten, ist beeindruckend. Und das nicht nur wegen der bloßen Menge an Informationen, der Genauigkeit ihrer Verarbeitung, oder der Geschwindigkeit ihres Lernens.
Vor allem erstaunt die widerstandsfähige Dynamik des Gehirns: In einem durchschnittlichen Menschenleben funktioniert es gut 80 Jahre lang und fällt dabei fast niemals auch nur kurzzeitig aus. Wird uns doch einmal schwarz vor Augen, oder sehen wir doppelt, ist das so außergewöhnlich, dass wir zu Recht ärztliche Hilfe suchen.
Solche Resilienz ist nicht allein durch passive Redundanz zu erklären, sondern erfordert aktive Selbstkorrekturen. Diese erforsche ich sowohl experimentell als auch theoretisch.

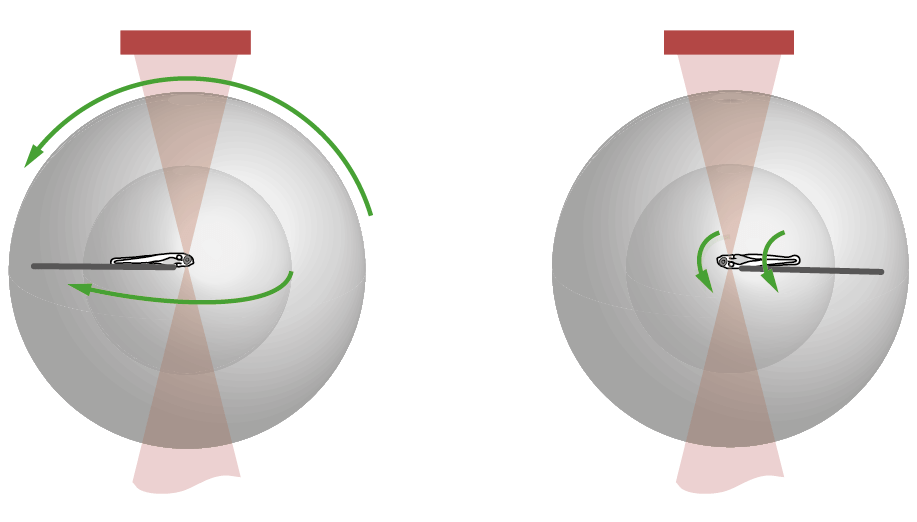
Abbildung: Viele Faktoren bestimmen die Arbeitsweise des Gehirns – vom Energiestoffwechsel des Gewebes bin hin zu (hier gezeigten) zeitlichen Verzögerungen durch “lange Leitungen” zwischen Neuronen. (Dehmelt 2022; Dissertation)
So habe ich durch Computersimulationen künstlicher neuronaler Netze untersucht, weshalb Nervenzellen einander so gut verstehen, obwohl die Informationen, die sie von ihren Nachbarzellen erhalten, immer erst nach einer gewissen Zeit ankommen. Weshalb kommt es nicht ständig zu Unter- oder Überreaktionen aufgrund veralteter Daten?
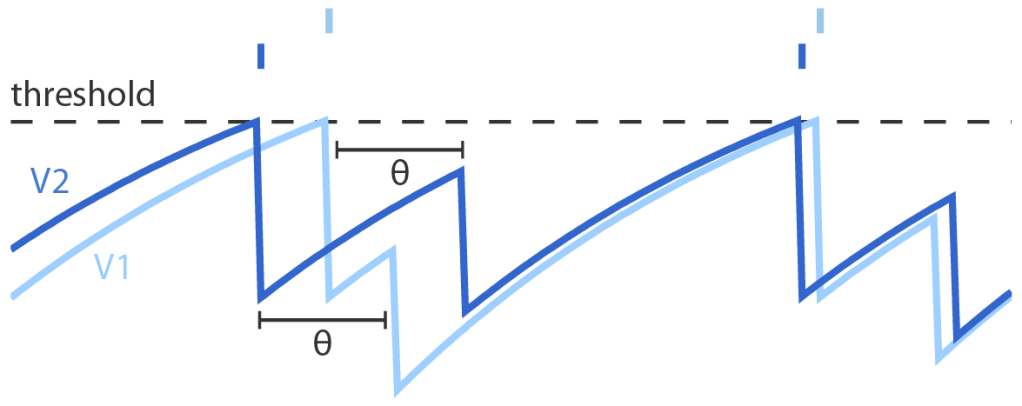
Abbildung: Erfahren miteinander verbundene Neurone erst nach einer Wartezeit θ von den Signalen des jeweils anderen, werden sie selbst unnötigerweise aktiv (hellblau), obwohl andere (dunkelblau) die anstehende Aufgabe bereits erfüllt haben. Dies führt zu unnötigen Aktionspotentialen und kann das ganze neuronale Netzwerk durch Kettenreaktionen destabilisieren. (Calaim, Dehmelt, Gonçalves, Machens 2022)
Das hat unter anderem mit den mathematischen Eigenschaften der wechselseitigen Verschaltung von Neuronen zu tun. Denn zu verarbeitende Informationen werden meist auf eine sehr große Zahl von Neuronen verteilt, die sich zudem selten auf nur eine der Aufgaben spezialisieren, sondern meist ein wenig zu allen Aufgaben beitragen. So ergibt sich ein hochdimensionaler Aktivitätsraum, dessen Geometrie kaum noch zu unserer normalen Intuition passt – und in dem die Aufgabenverteilung von zwei zufällig gewählten Neuronen zwei fast immer nahezu orthogonalen Richtungen entspricht. Das heißt: Verteilt man 20 Aufgaben an 2.000 Neurone, statt 2x nebeneinander je 10 Aufgaben an je 1.000 Neurone zu delegieren, funken sich die Nervenzellen tatsächlich viel weniger oft dazwischen, und die Informationsverarbeitung wird resilient gegenüber langen Leitungen, Rauschen, und anderen Herausforderungen.
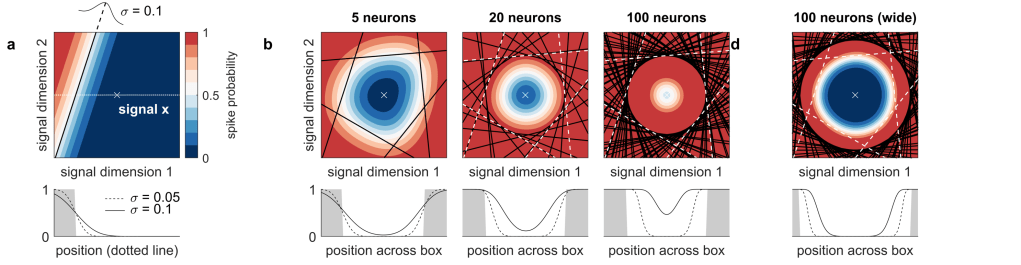
Abbildung: Sind die zwischen den Neuronen ausgetauschten Signale nicht 100% präzise, sondern geringfügig verrauscht, können die eigentlich selbstkorrigierenden Netzwerkeigenschaften zu Kettenreaktionen führen. Diese lassen sich durch trägere Reaktion einzelner Neurone vermeiden. (Calaim, Dehmelt, Gonçalves, Machens 2022)
Das haben wir anhand eines mathematischen Modells biologisch inspirierter, aktionspotentialbasierter Neurone untersucht und unsere Ergebnisse in der renommierten Fachzeitschrift eLife veröffentlicht. Dafür haben wir unter anderem eine geometrische Visualisierungstechnik weiterentwickelt, mit der auch andere inspizieren können, was in den von ihnen beobachteten neuronalen Netzen vor sich geht.
Calaim, N.*, Dehmelt, F. A.*, Gonçalves, P. J.* & Machens, C. K. (2022) The geometry of robustness in spiking neural networks. eLife 11:e73276. https://doi.org/10.7554/eLife.73276 (* equal contributions) – Editor’s evaluation: “The article introduces a geometrical interpretation for the dynamics and function of certain spiking networks, based on the earlier work of Machens and Denève. Given that spiking networks are notoriously hard to understand, the approach could prove useful for many computational neuroscientists. Here, that visualization tool serves to assess how fragile the network is to perturbation of its parameters, such as neuronal death, or spurious noise in excitation and inhibition.”
Doch ein theoretisches Modell ist immer nur so gut wie sein Bezug zur Realität. Ob es tatsächlich sinnvoll ist und seine Vorhersagen irgendetwas mit real existierenden Nervenzellen zu tun haben, müssen wir deshalb immer wieder mit echten Lebewesen vergleichen.
Welches menschliche oder nichtmenschliche Tier wir betrachten, hängt von vielen Faktoren ab. Für meine Forschung ist z.B. wichtig, möglichst viele Nervenzellen gleichzeitig zu beobachten – und in Erfahrung zu bringen, wie gut oder schlecht deren Informationsverarbeitung gerade ist. Also nicht nur die Aktivität des Gehirns anzusehen, sondern auch zu bewerten, wie gut dessen Performance beim Erledigen einer Aufgabe wirklich ist. Genau welcher der unzähligen Aufgaben des Gehirns ich zuschaue, ist gar nicht so wichtig – Hauptsache, ich kann “gut gemacht” von “schlecht gemacht” unterscheiden.
Deshalb habe ich mich für winzig kleine Fischlarven entschieden – nämlich Zebrabärblinge. Diese sind weniger als einen Millimeter breit und wenige Millimeter lang. Und sie sind durchsichtig, sodass wir mit einem Mikroskop von außen beobachten (und filmen!) können, wann welche Nervenzellen genau wie stark aktiv sind.
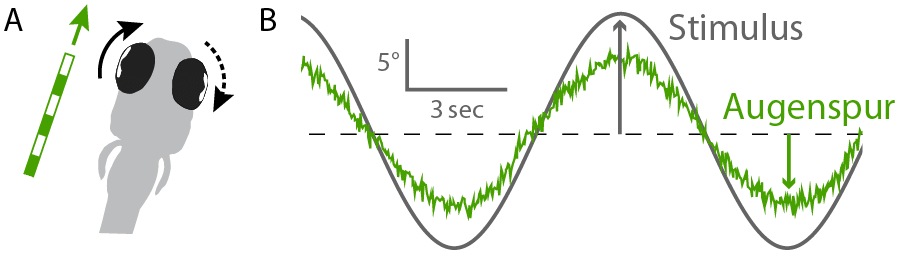
Abbildung: (A) Videos mit bewegten Balkenmustern regen Fische zu wiederholten Augenbewegungen an. (B) Diese Bewegungen erlauben uns, die Präzision der Informationsverarbeitung im Gehirn zu messen und so die Aktivität der Neurone zu interpretieren. (Dehmelt, Meier, Hinz et al. 2022)
Dafür zeigen wir ihnen extrem langweilige Filme – z.B. Balkenmuster, die sich immer wieder von links nach rechts bewegen. Denn das löst bei den Fischen einen Reflex namens OKR (“optokinetic response”) aus, durch den sie minuten- und stundenlang geduldig versuchen, den bewegten Mustern mit den Augen zu folgen. Vergleichen wir Augen- und Musterbewegungen, können wir sehr genau ausrechnen, wie gut der für die Gehirnteil, der die Augen steuert, seinen Job gerade erledigt.
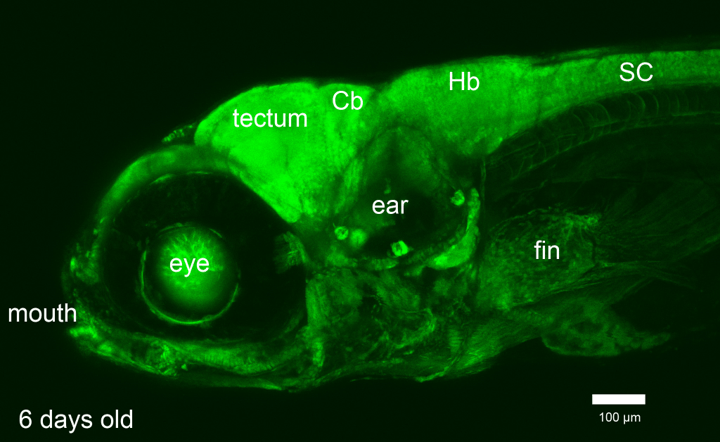
Abbildung: Bringen wir die Nervenzellen des Fischgehirns dazu, fluoreszierende Farbstoffe herzustellen, können wir am Leuchten der Neurone ablesen, wie aktiv sie gerade miteinander kommunizieren. (6 Tage alte Fischlarve der transgenen Linie Et(E1b:Gal4-VP16)s1101t, Tg(UAS:Kaede)s1999t; A. Arrenberg 2009, Dissertation)
Dafür haben wir ein Zweiphotonenmikroskop, Infrarotkameras , Videoprojektion, Optogenetik und andere Techniken kombiniert, eine Software zur Steuerung und Auswertung entwickelt, und all das öffentlich bereit gestellt. Damit untersuchen wir grundsätzliche Fragen zur “Sprache” neuronaler Netze – manchmal tauchen aber auch Fragen zur Lebenswelt der Fische selbst auf. So haben wir etwa untersucht, auf welche Bereiche seiner Umgebung die in flachen Teichen und Reisfeldern lebenden Tiere besonders achten.
Dehmelt, F. A., von Daranyi, A., Leyden, C. & Arrenberg, A. B. (2018) Evoking and tracking zebrafish eye movement in multiple larvae with ZebEyeTrack. Nature Protocols 13:1539-1568. https://doi.org/10.1038/s41596-018-0002-0
Dehmelt, F. A.*, Meier, R.*, Hinz, J.*, Yoshimatsu, T., Simacek, C. A., Huang R., Wang, K., Baden, T. & Arrenberg, A. B. (2021) Spherical arena reveals optokinetic response tuning to stimulus location, size, and frequency across entire visual field of larval zebrafish. eLife 10:e63355. https://doi.org/10.7554/eLife.63355 (* equal contributions)

3R-Forschung
Mit Tieren zu arbeiten, bedeutet aber auch, Verantwortung für ihr Wohlergehen zu übernehmen – und sie überhaupt nur dann zu nutzen, wenn es nicht anders geht. Selbstverständlich nutzen wir immer auch tierfreie Untersuchungsmethoden wie Computersimulationen, die Untersuchung von Gewebeproben, usw.
Natürlich halten wir uns dabei an alle rechtlichen Vorschriften, gehen aber selbstverständlich freiwillig darüber hinaus. Verbindlich ist unter anderem eine behördliche Genehmigung – denn jeder Tierversuch ist illegal, sofern keine Ausnahmegenehmigung vorliegt, genau diesen Versuch an genau diesen Tieren auf genau diese Weise in genau diesem Zeitraum mit genau diesen Kolleg:innen durchzuführen. Und das ist gut so!
Verbindlich (und für uns selbstverständlich) ist aber auch die Orientierung am sogenannten 3R-Prinzip: Reduce, Refine, Replace. Also: möglich wenige Tiere in jeder Studie untersuchen, jede Untersuchung möglichst schonend gestalten, und jeden Versuch mit Tieren wo immer möglich durch Versuche ohne Tiere ersetzen.
Dazu engagiere ich mich seit langem auch im Bundesnetzwerk 3R des Bundesministeriums für Bildung und Forschung (BMBF), sowohl durch Vorträge und Workshops bei den Netzwerktreffen als auch durch das BMBF und andere Förderer wie das Bundesinstitut für Risikobewertung (BfR, Bf3R) geförderte Forschungsprojekte zum Wohlergehen unserer Tiere.
So haben wir zum Beispiel untersucht, wie die Wahrnehmung von Fischen durch Veränderungen ihrer Umgebungsbedigungen beeinträchtigt wird, wie sie Betäubungsmittel und Kälte reagieren, und wie sich echte, wirksame Betäubung von einer bloßen Regungslosigkeit unterscheiden lässt – denn Fische können uns ihre Empfindungen ja nicht selbst mitteilen!
Leyden, C., Brüggemann, T., Debinski, F., Simacek, C. A., Dehmelt, F. A. & Arrenberg, A. B. (2022). Efficacy of tricaine (MS-222) and hypothermia as anesthetic agents for blocking sensorimotor responses in larval zebrafish. Frontiers in Veterinary Science 9:864573. https://doi.org/10.3389/fvets.2022.864573
Wir stellen uns aber auch besonders schwierigen Themen – denn wo immer Tiere in unserer Gesellschaft genutzt werden (in der Landwirtschaft, als Haustiere, in Zoos und in der Forschung), werden sie auch getötet. Und wenn das geschieht, ist es wichtig, es auf die für das Tier selbst am wenigsten schlimme Weise zu tun. Doch was bedeutet das?
Hier haben wir genauer nachgeschaut, eine alternative und besonders schnelle Betäubungs- und Tötungsweise mit Strom statt z.B. mit langsamen Pharmaka untersucht, und beobachtet, was dabei im Gehirn passiert, und wie viel (oder in unserem Fall: wie wenig!) Fische davon miterleben.
Auch das gehört zu unserer Verantwortung, und wir dürfen nicht wegsehen.
Seit Ende 2025 bin ich deshalb als Wissenschaftlicher Mitarbeiter am neuen Institut für Versuchstierkunde der HHU Düsseldorf beteiligt, wo ich meine Forschung zum Tierwohl und seinen neurowissenschaftlichen Grundlagen unbefristet fortsetzen kann.
Burkhardt, D.-S., Leyden, C., Thomas, C., Brysch, C., Dehmelt, F. A. & Arrenberg, A. B. (28 March 2024). Behavioral and Neurophysiological Effects of Electrical Stunning on Zebrafish Larvae, PREPRINT (Version 1) available at Research Square, https://doi.org/10.21203/rs.3.rs-4021167/v1